这种调控新机制,开启了免疫治疗的一扇新的大门!
我们在生活中经常会听到免疫这个名词,它是人体的一种生理功能,人体依靠这种功能识别人体的成分,从而破坏和排斥进入人体的抗原物质,或人体本身所产生的损伤细胞和肿瘤细胞等,达到维持人体的健康的目的。
免疫也是指抵抗或杜绝微生物或寄生物的感染或人体所不接受的的生物体侵入,所产表现。生的一种免疫涉及特异性成分和非特异性成分。非特异性成分不需要事先暴露,可以立刻回应,可以有效地防止各种病原体的入侵。特异性免疫是在生命体的生存期内发展起来的,是专门针对某个病原体的免疫。
今天我们重点讲的是体液免疫(humoral immunity),它是以以效应B细胞产生抗体来达到保护目的的免疫机制,主要负责体液免疫的细胞是B细胞。体液免疫的抗原多为相对分子质量在一万以上的蛋白质和多糖大分子,同时带有不同抗原的病毒颗粒和细菌表面,也能引起体液免疫反应。
研究人员深入研究了B细胞的免疫特性,并且探究了了经典共抑制分子PD-1如何调控T细胞被招募迁移进入滤泡区的过程,近日清华大学免疫学研究所祁海教授课题组,在Immunity杂志上,发表了一篇名为《PD-1 controls follicular T helper cell positioning and function》的文章,深入研究了经典共抑制分子PD-1如何调控T细胞被招募迁移进入滤泡区,帮助B细胞建立生发中心反应,并产生高亲和力抗体的分子机制,将为免疫治疗的发展产生新的路径。
这篇文章的第一作者为史静雯博士,侯诗玥博士、刘欣博士和CLS博士生方谦也做出了重要贡献。
史静雯认为外来病原体入侵人体时,本处于于淋巴组织T细胞区的抗原特异性CD4+ T细胞能够在活化后迁移至B细胞滤泡区,帮助B细胞建立生发中心。
在这个B细胞建立的中心,随着体细胞高频突变,B细胞大量增殖,通过亲和力筛选产生高亲和力抗体和长效体液免疫。这类定位于滤泡区的CD4+ T细胞亚群被称作滤泡辅助性T细胞,它们是体液免疫的重要调控细胞亚群。
T细胞招募进入滤泡区的过程,依赖能响应滤泡区趋化因子的CXCR5受体和共刺激分子ICOS,ICOS介导的T细胞运动依赖于PI3K通路的活性和滤泡区抗原非特异性初始B细胞上持续表达的ICOSL。然而,ICOS在T细胞区域并不调控T细胞运动,这可能从某种意义上说明了滤泡区微环境可能为T细胞深入迁移设置了某种无法进入的屏障,使得路途不通畅。
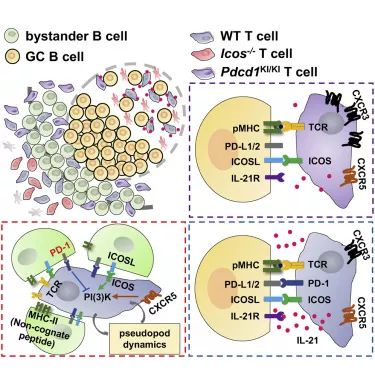
经过研究发现,TFH细胞标志分子PD-1是参与抑制T细胞招募进入滤泡区的关键信号分子,并且这种抑制来源于滤泡区幼稚B细胞上持续高表达的配体PD-L1。PD-1受体接受刺激时即可抑制CXCR5或ICOS诱导的PI3K活性,而这一抑制作用不需要TCR信号,被认为是抗原非依赖的旁观工作模式。而PD-1过表达的T细胞在体内显示出向滤泡区归巢的缺陷。
通过利用基因工程小鼠实验,T细胞活化后无法上调PD-1表达,作者证明了抑制PD-1上调就可以拯救ICOS信号缺失下T细胞无法进入滤泡区的缺陷。实验解释了在TFH形成的过程中,在T-B交界区开始需要ICOS信号来促进PI3K活化而帮助T细胞迁移进入滤泡区。
科研组将PD-1对TFH细胞的功能调控进行了研究,发现PD-1信号虽然对T细胞招募进入滤泡区起抑制作用,但却可以帮助已经进入滤泡区的TFH细胞集中于需要它们发挥功能的生发中心区域。在生发中心内部,无论当TFH细胞无法上调PD-1还是B细胞上缺失PD-L1,都会导致B细胞数量增加,但亲和力下降,说明PD-L1-PD-1信号是生发中心亲和力筛选的保证因素之一。
这一工作描绘了TFH细胞招募过程,揭示了一向被忽视的抗原非特异性幼稚B细胞的重要功能和经典共刺激分子ICOS和PD-1在无TCR信号下的旁观工作模式,为未来改进疫苗研发提供了新思路,对其它炎症或癌症组织的治疗也有着启迪。
转自解螺旋