我国科学家揭示生命体自我保护行为背后的分子机制
10月2日,《自然》杂志在线发表了我国科学家的一项关于免疫系统如何发挥作用的重要成果。通过海量的实验与计算,来自中国科学院物理所、中国医学科学院等单位的研究人员,成功解析与原核短Ago系统相关的高分辨率三维蛋白结构,同时彻底弄清楚了原核短Ago系统在病毒入侵前后所发生的结构变化。
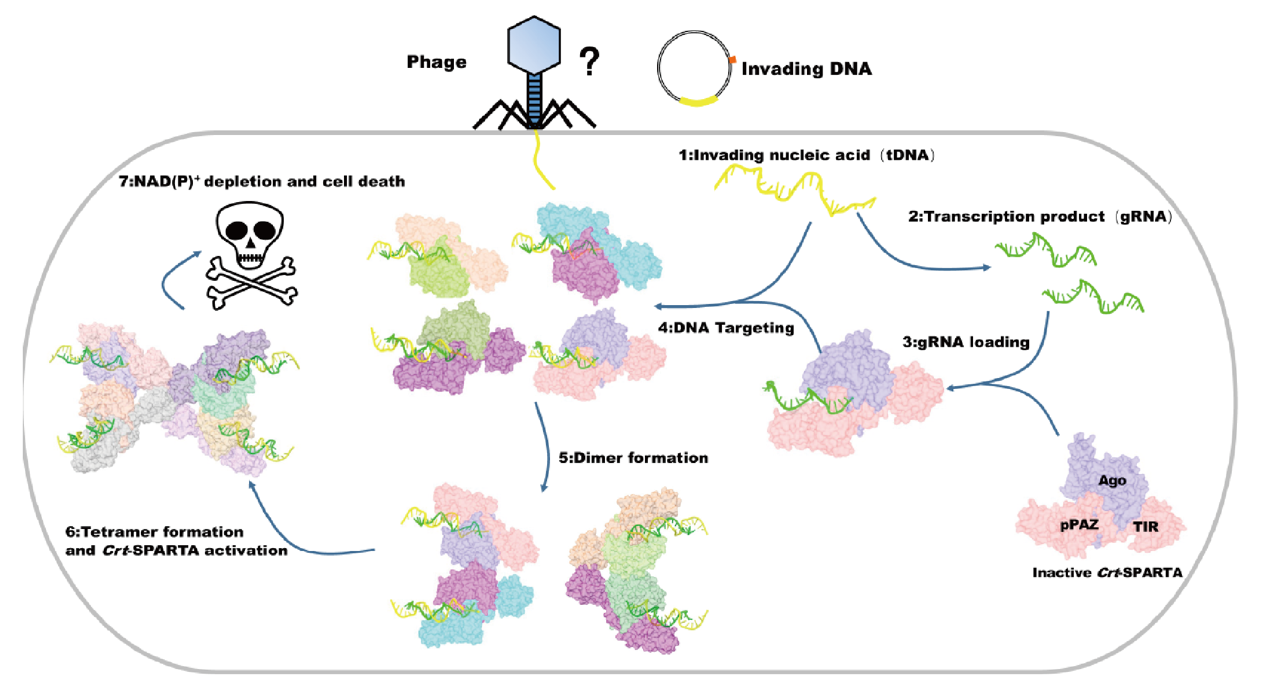
原核短Ago中辅酶I的激活机制以及导致细菌死亡的分子机理。中国科学院物理所供图
在自然界中,生命体时刻都需要应对各种外部入侵,如细菌、病毒等。为有效应对这些入侵,生命体的细胞会产生一种叫作核糖核酸的分子。这些核糖核酸分子可以通过一种被称为转录后基因调控的过程,对我们的基因进行调控。我们都知道基因是我们身体内部的指令,它们决定了我们长什么样、如何工作等等。通过转录后基因调控,核糖核酸分子可以激活特定的基因,使细胞产生抗体或其他防御机制来对抗入侵者。
“因此,核糖核酸诱导的转录后基因调控在我们身体的免疫系统中起着至关重要的作用,可以帮助我们抵御外部入侵,并保护我们的健康。”论文共同通讯作者、中国科学院物理所副主任工程师丁玮说。
Argonaute(Ago)蛋白就是一种能够接受外源核酸诱导,并行使防御机制对抗入侵者的功能载体。Ago蛋白存在于古菌、细菌和真核生物等生命体中,它为非编码小核糖核酸提供锚位点,达到降解靶基因或者抑制翻译的目的。在生命体健康的情况下,Ago蛋白会以个体的形式在生命体内游弋。当检测到病毒的核酸入侵时,它们会迅速组合成功能单位,迅速分解体内的辅酶I(NAD+,即烟酰胺腺嘌呤二核苷酸)。
“辅酶I是负责传递氢离子的辅酶,参与生命体内的糖酵解、呼吸链等生命活动。”丁玮说,它的大量消耗意味着被病毒感染的生命体会迅速走向死亡。而随着宿主的死去,入侵的病毒同样无法继续生存,从而不可能继续复制再去侵染其他的生命体。
“早在20世纪50年代,科学家们就通过间接的手段检测到了生命体内存在着这种同归于尽的自我保护行为,但受限于当时的软硬件水平,这一过程的实现机制,一直是困扰科学家们的谜题。”丁玮说。
研究团队通过高分辨冷冻电镜技术与自主研发的自动化结构解析策略,在数百万计的冷冻电镜蛋白质颗粒中,高效地筛选并重构了与原核短Ago系统相关的高分辨率三维蛋白结构,并以此结构为基础结合体外功能实验,彻底揭示了原核短Ago系统在病毒入侵前后所发生的结构变化。
丁玮表示,这项研究成果对于深入理解原核短Ago系统如何发挥功能提供了重要的结构基础,同时也最终揭示了原核短Ago中降解辅酶I的激活机制,以及导致细菌等生命体死亡的分子机理,为后续对人体免疫系统的研究以及相关药物的研发提供了结构基础和理论指导。
来源:科技新闻
转载自中国科技网